método analítico
Método de análisis para la determinación de la composición de ácidos grasos de los lípidos totales del tejido adiposo subcutáneo de cerdos ibéricos
ASICI está acreditada para el análisis de la composición de ácidos grasos mediante cromatografía de gases con detección de ionización de llama (CG-FID) según su procedimiento interno IT-15, adaptación del método oficial según Orden PRE/3844/2004, de 18 de noviembre.
Descargar presentación Método Analítico (Power Point. 13,4 MB)- Introducción
- Material y Aparatología
- Reactivos
- Procedimientos
- Expresión de Resultados
- Fiabilidad
- Bibliografía
1. Introducción
La alimentación que reciben los cerdos durante su cría y cebo determina en gran medida la composición de la grasa depositada en sus tejidos (adiposo y muscular).
A partir de la muestra representativa del lote de sacrificio, extracción a temperatura ambiente con disolvente o con horno microondas, de los lípidos totales. Obtención de los ésteres metílicos de los ácidos grasos por reacción con una solución de hidróxido de potasio y su posterior análisis por cromatografía gas-líquido.
El presente método es aplicable a la determinación de la composición de ácidos grasos de los lípidos totales en el tejido adiposo subcutáneo de cerdos ibéricos mediante cromatografía de gases.
2. Material y Aparatología
- 2.1 Material auxiliar adecuado
- 2.2 Matraz de 125 mL con boca esmerilada
- 2.3. Embudos de filtración y medio filtrante
- 2.4. Bolsas estériles/asépticas (80 y/o 400 mL) para homogeneizador con o sin filtro y resistentes al disolvente
- 2.5. Recipientes para microondas
- 2.6. Tubos de ensayo de 5 mL y 10 mL
- 2.7. Rotavapor unido a una bomba de vacío y baño de agua
- 2.8. Bomba de vacío
- 2.9. Centrífuga
- 2.10. Cromatógrafo de gases con columna capilar, inyector de división de flujo y detector de ionización de llama
- 2.11. Columna capilar con fase estacionaria polar o muy polar
- 2.12. Micropipetas
- 2.13. Microjeringa para cromatografía de gases
- 2.14. Dosificadores
- 2.15. Homogeneizador de palas
- 2.16. Balanza analítica con precisión de 0,001 g
- 2.17. Horno de microondas
- 2.18. Picadora
3. Reactivos
- 3.1 Hidróxido de potasio en lentejas, calidad PA
- 3.2 Metanol absoluto (99.8%) calidad PA
- 3.3. Solución metanólica de hidróxido de potasio 2M: disolver, enfriando, 11,2 g de hidróxido de potasio (3.1) en 100 mL de metanol (3.2). Enfriar a temperatura ambiente.
- 3.4. éter dietílico calidad PA, exento de peróxidos y de residuos.
- 3.5. n-hexano, calidad PA.
- 3.6. éter de petróleo calidad, PA.
- 3.7. n-heptano, calidad PA.
Nota: El éter dietílico es altamente inflamable y puede dar lugar a la formación de peróxidos explosivos
4. Procedimiento
Preparación de la muestra en el laboratorio.

4.1.1 Obtención de tiras: cuando el ejemplar de muestra esté constituido por láminas, de cada una de las láminas recibidas, se cortará en el centro una tira de 2 a 5 mm , conservando piel y magro.

4.1.2 Picado/trituración y homogeneización de tiras: a las tiras obtenidas, se les eliminará únicamente la piel y el magro, y se triturarán/picarán (2.18) y homogeneizarán antes de iniciar la obtención de lípidos totales.
4.2 Obtención de lípidos totales
Introducir la muestra picada y homogeneizada en una bolsa de plástico estéril/aséptica, resistente al disolvente (2.4), pesar y adicionar un volumen de éter dietílico (3.4) apro x imadamente igual a dos veces el peso de la muestra picada (relación 1:2). La bolsa se introduce en homogeneizador de palas (2.15) y se activa de 2 a 4 minutos. Transcurrido el tiempo de obtención de lípidos totales, el contenido de la bolsa se filtra (2.3) a un matraz (2.2) para separar el e x tracto del residuo sólido (tejido conectivo). El matraz con el e x tracto se lleva a rotavapor, bajo vacío, con baño calefactor entre 40ºC-50ºC (2.7) hasta eliminación del disolvente. De los lípidos totales contenidos en el matraz, una alícuota se trasvasa a viales o tubos de ensayo de 5 mL, mínimo (2.5) para almacenar y conservar, en su caso, en congelador a una temperatura inferior a -10 ºC. La otra alícuota se destina a la preparación de los ésteres metílicos (4.3).

4.3 Preparación de los ésteres metílicos
En tubo de ensayo de 10 mL (2.6), pesar con precisión de +-0,01g , 0,20 g de los lípidos totales obtenidos. Añadir 4 mL de disolvente (3.5) y agitar suavemente hasta disolución de la grasa. A continuación adicionar 0,2 mL de disolución 2M de KOH en metanol (3.3). Agitar suavemente para favorecer la reacción. Dejar en reposo 30 minutos hasta clarificación total. Centrifugar (2.9) 30 segundos a 2000 r.p.m. Decantar la capa superior que es la que contiene los ésteres metílicos. Mantener la solución en el frigorífico hasta el análisis cromatográfico. No almacenar la solución más de 12 horas. A continuación, con ayuda de una microjeringa (2.13) tomar como mínimo 0,5 µL de la fase superior (disolución de los ésteres metílicos) e inyectar en el cromatógrafo de gases (2.10).

4.4 Cromatografía en fase gaseosa de los ésteres metílicos.
A modo de orientación, las condiciones operativas podrían ser las siguientes:
- Columna Capilar
- Fase estacionaria: polar o muy polar.
- Flujo de gas portador: dependiendo del diámetro interior de la columna.
- Tª Horno: desde un mínimo de 160ºC.
- Tª Inyector: mínimo 230ºC.
- Tª Detector (FID): mínimo 250ºC.
- Relación de división de flujo: adecuada para la separación requerida.
Estas condiciones operativas deberán permitir una resolución de los ácidos aráquico y linolénico de, al menos, 1,5.
5. Expresión de Resultados
Se efectuará como % de área de los picos de los siguientes ácidos grasos:
- C12:0 Acido Láurico
- C14:0 Acido Mirístico
- C16:0 Acido Palmítico
- C16:1 Acido Palmitoleico (incluidos isómeros)
- C17:0 Acido Margárico
- C17:1 Acido Margaroleico
- C18:0 Acido Esteárico
- C18:1 Acido Oleico (incluidos isómeros)
- C18:2 Acido Linoleico (incluidos isómeros)
- C18:3 Acido Linolénico (incluidos isómeros)
- C20:0 Acido Aráquico
- C20:1 Acido Gadoleico
El total de áreas individuales de tales componentes debe ser el 100%. El cálculo de los porcentajes se obtiene a partir de la siguiente fórmula:
![]()
A modo de orientación, se muestra un cromatograma de referencia, para la identificación de los picos
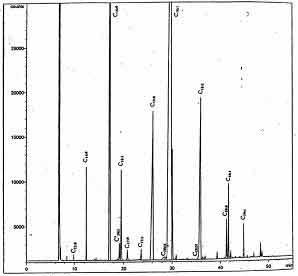
6. Fiabilidad
Repetibilidad: Precisión bajo condiciones de repetibilidad.
Condiciones de repetibilidad: condiciones bajo las que se obtienen resultados independientes, con el mismo método, sobre idénticas muestras, en el mismo laboratorio, por el mismo operador, y utilizando los mismos equipos de medición, durante un corto intervalo de tiempo.
Reproducibilidad: Precisión bajo condiciones de reproducibilidad.
Condiciones de reproducibilidad: condiciones bajo las cuales los resultados se obtienen con el mismo método sobre muestras idénticas, en laboratorios diferentes, con operadores distintos y utilizando equipos diferentes.
Resultados de un estudio interlaboratorios.
Ver resultados7. Referencias
Norma UNE-EN ISO 5508:1990.












